相信各位目前已到紅、黃糖的階段了這個時候就會發現原油變成最有用的物質了——既可以產氫,又可以產精煉油,製作塑料、硫酸最後至有機晶體等等。煤可以製作石墨、金剛石和燃燒單元、增產劑等,用途非常廣泛。事實上,在現代社會中,石油和煤炭目前仍是非常重要的原料。下面就來說說:
石油化工和塑料
撒在農田裡的化肥,穿在身上的滌綸衣物,汽車賴以活動的燃油,還有你抓著的手機或者鼠標的塑料殼……石油化工的產物遍佈在我們生活中的方方面面,因此石油被稱為現代工業的血液。

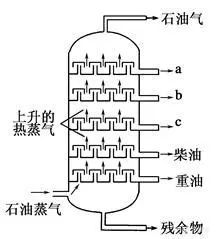
從油井獲取的原油通過分餾和裂化、裂解,可以得到各類烷烴,烯烴,芳香烴,然後製作塑料、洗滌劑,潤滑油等石化產品。還記得高中化學重點說過,石油的分餾是物理變化而石油的裂化、裂解是化學變化。具體過程是,把石油加熱到沸騰,通過分餾塔,(Cx表示分子的碳原子數為x)C5以下的為氣體,C5-C8的為溶劑油,C5-C11的為汽油,C10-C15、C11-C16、C15-C18分別為航空煤油、煤油、柴油,其餘的為重油。石油的裂化是將重油隔絕空氣加強熱(400℃-600℃)分解為相對分子質量較小、沸點較低的燃料油,包括熱裂化和催化裂化。石油的裂解是用重油以比裂化更高的溫度(700~800℃,有時甚至高達1000℃以上)使具有長鏈分子的烴斷裂成各種短鏈的氣態烴和少量液態烴,工業以此制乙烯。
然後再將乙烯等單體小分子經過聚合反應(加聚或縮聚反應)形成大分子,大分子之間通過等一系列過程形成塑料。加聚反應,即加成聚合反應,是一些含有不飽和鍵(雙鍵、三鍵、共軛雙鍵)的化合物或環狀低分子化合物,在催化劑、引發劑或輻射等外加條件作用下,同種單體間相互發生加成反應(簡單來說就是打開不飽和鍵分別與周圍的分子形成新的單鍵,要不然說不完了)形成新的共價鍵相連大分子的反應就是加聚反應。,例子有聚乙烯、聚丙烯、聚苯乙烯等。縮聚反應,即縮合聚合反應,是指由一種或多種單體相互發生縮合反應(一般為酸與醇形成酯或者酸與胺形成酰胺的縮合反應)生成高分子的反應,單體為帶有2個(或以上)反應官能團的化合物聚合時脫去小分子形成聚合物。如果單體只有一種稱均縮聚,如聚己內酰胺;如果單體為兩種及以上,稱共縮聚,如聚己二酰己二胺。
塑料為什麼有的像聚乙烯一樣稍微有力就會變形扯碎,而有的像酚醛樹脂一樣是堅固的固體呢?因為聚合反應包括線型聚合反應和體型聚合反應反應。前者是隻有兩個官能團的單體向兩個方向發展而成線型高分子的聚合反應,形成的是二維的結構,而第三維之間僅通過偶爾的交聯或者靜電吸引連接;而後者是是有兩個以上的官能團的單體向三個方向發展而成體型高分子的聚合反應,形成的是三維的結構,因此更有力。
戴森球計劃中的原油在無論什麼資源丰度設定下都是無限的,只有產出速度的區別,這與現實世界大相徑庭。不過有一點設定倒是貼切現實——只有宜居或者曾經宜居的星球才能產生原油。因為根據目前的主流理論——生物成油論而言,石油是古代生物質在地層中經過了漫長的轉化——反覆壓縮和加熱而形成的,海洋中的藻類等浮游生物是形成石油的主力。這一理論也解釋了石油只存在於淺層地表,並且儲量相當有限,因此認為石油一種化石資源。
煤炭與煤工業
煤炭是另一重要的工業原料,首先煤炭是主要的燃料,無論是冬天的家庭取暖,還是用於發電等,煤炭都在其中發揮主要作用。目前我國發電量的超過60%是燒煤的火電,且我國廣大農村地區冬天取暖還依賴於燒煤。
其次,煤炭也經歷分餾和乾餾等化學過程,可以得到焦爐煤氣、粗氨水、粗苯、煤焦油、焦炭等一系列產物,進而可以製作化肥、農藥、石墨、碳素、電石燈煤工業產品。還記得高中化學重點說過,煤的分餾是物理變化而煤的乾餾是化學變化。具體過程是,當煤料的溫度高於100℃時,煤中的水分蒸發出;溫度升高到200℃以上時,煤中結晶水釋出;高達350℃以上時,粘結性煤開始軟化,並進一步形成粘稠的膠質體(泥煤、褐煤等不發生此現象);至400~500℃大部分煤氣和焦油析出,稱一次熱分解產物;在450~550℃,熱分解繼續進行,殘留物逐漸變稠並固化形成半焦;高於550℃,半焦繼續分解,析出餘下的揮發物(主要成分是氫氣),半焦失重同時進行收縮,形成裂紋;溫度高於800℃,半焦體積縮小變硬形成多孔焦炭。當乾餾在室式乾餾爐內進行時,一次熱分解產物與赤熱焦炭及高溫爐壁相接觸,發生二次熱分解,形成焦爐煤氣和其他化學產物。
相較而言煤炭在遊戲中的作用沒那麼多——可能因為煤在星區總儲量也沒那麼多的原因吧不過有一點設定倒是貼切現實——只有宜居或者曾經宜居的星球才能產生煤炭。因為根據目前的主流理論——生物成煤論而言,煤炭是古代生物質在地層中經過了漫長的轉化——反覆壓縮和加熱而形成的,陸地中被掩埋的古植物是形成煤炭的主力。這一理論也解釋了煤炭只存在於淺層地表,並且儲量相當有限,因此認為煤炭一種化石資源。
分餾
上面提到在石油與煤多次提到了分餾,那麼這裡好好說一下分餾的原理:分餾是對某一混合物進行加熱,針對混合物中各成分的不同沸點進行冷卻分離成相對純淨的單一物質過程,過程中沒有新物質生成,只是將原來的物質分離,屬於物理變化。
用分餾柱進行分餾,被分餾的溶劑在蒸餾瓶中沸騰後,蒸氣從圓底燒瓶蒸發進入分餾柱,在分餾柱中部分冷凝成液體。此液體中由於低沸點成分的含量較多,因此其沸點也就比蒸餾瓶中的液體溫度低。當蒸餾瓶中的另一部分蒸氣上升至分餾柱中時,便和這些已經冷凝的液體進行熱交換,使它重新沸騰,而上升的蒸氣本身則部分地被冷凝,因此,又產生了一次新的液體-蒸氣平衡,結果在蒸氣中的低沸點成分又有所增加。這一新的蒸氣在分餾柱內上升時,又被冷凝成液體,然後再與另一部分上升的蒸氣進行熱交換而沸騰。由於上升的蒸氣不斷地在分餾柱內冷凝和蒸發,而每一次的冷凝和蒸發都使蒸氣中低沸點的成分不斷提高。因此,蒸氣在分餾柱內的上升過程中,類似於經過反覆多次的簡單蒸餾,使蒸氣中低沸點的成分逐步提高。
在工業中有許多實際應用,比如製造高濃度烈酒,酒精會在78.4℃沸騰為酒精蒸氣,水在100℃沸騰為水蒸氣,將低度數的酒加熱到酒精的沸點以上,又不達到水的沸點,隨後收集酒精蒸氣,冷凝以後就是更高濃度的酒了。
而戴森球計劃中的分餾塔用於在氫中獲取重氫(氘),在現實中也是一個重要的製取氘的途徑。液氫的沸點是-252.87 °C,而液氘的沸點是-249.5℃,利用這一細微的沸點差異,就可以在自然界的氫中提取大約七千分之一濃度的氘。當然,現實中是不可能實現像遊戲裡那樣液氫轉轉轉效果的。
火箭
目前,人類用於航天探索的器具全都是火箭。它可以通過向後拋射高速物質來獲得給航天器的向前進速度。
儘管有著許多早期探索,不過用火箭技術探索宇宙空間的且符合科學方法的研究,始於俄國教師康斯坦丁·埃杜阿爾多維奇·齊奧爾科夫斯基在1903的一篇理論論文《利用反作用力設施探索宇宙空間》。不過,他的工作很大程度上在當時被埋沒了。而另一個先驅者,美國發明家羅伯特·哈金斯·戈達德,不僅實際製造了一些火箭,還進一步論述了用火箭探索宇宙的可能性。然而在當時,大眾媒體幾乎是以嘲笑的態度看待他的努力,他們認為在真空的太空當中,因為無法依靠“作用力與反作用力”獲得向前進的速度,太空探索其實是無稽之談。當然,在今天的我們,已經見識過飛往月球,飛往火星的壯舉,也知道近地軌道有無數衛星在環繞,並不會對太空探索的可能性有什麼懷疑。不過,在那個年代,“太空探索是不可能的”,幾乎是大眾廣泛認知的常識,只有真正瞭解物理學的人才能理解用火箭在宇宙中航行的可能性。人在地面上行走,腳踩著地面,給大地施加向後的推力,被大地施加向前的反作用力而前進;輪船在海里航行,螺旋槳將水流往身後推動,從而讓輪船向前行進;飛機在空中飛行,將空氣從前邊的進氣口吸入,從後方噴出,於是能在天空中四下翻飛。但太空是真空,既不能腳踏實地,也沒有可以划動的水,又沒有能夠吸入的空氣,要怎麼在這樣的環境中航行呢?答案就是,向後拋射高速物質。對於宏觀物體來說,應用動量守恆的原理可以很容易理解這一點。你往一個方向噴射出的物質的動量,就等於你的剩餘部分往相反方向獲得的動量。這就是有工質的火箭的原理。化學能火箭會將燃料與氧化劑放一起燃燒,然後讓急劇膨脹的氣體往身後噴射,從而能夠向前進發。離子發動機則是用電場,將電離後的氣體往身後高速噴出,因為可以獲得更高的噴射速度,且電場控制的矢量範圍更大,離子發動機可以取得比化學能火箭發動機高得多的比衝,已經應用在深空衛星的變軌動力當中。
